Präambel
Das Ziel des 3R-Prinzips ist es, Tierversuche vollständig zu ersetzen (Replace), die Zahl der Versuchstiere zu reduzieren (Reduce) und die Versuche für die Tiere so wenig belastend wie möglich (Refine) zu gestalten.
Zurückzuführen ist das Prinzip auf die beiden Wissenschaftler William Russel und Rex Burch. Sie erwähnten die „3R“ erstmalig 1959 als Grundsatz der experimentellen wissenschaftlichen Arbeit in dem Buch „The Principles of Humane Experimental Technique“.
2010 wurde das 3R-Prinzip durch die Aufnahme in die Europäische Richtlinie 2010/63/EU international gesetzlich anerkannt. Durch die Novelle des Tierschutzgesetzes und der Tierschutz-Versuchstierordnung ist das 3R-Prinzip seit 2013 auch im deutschen Recht fest verankert.
Im Folgenden sind exemplarisch verschiedene Beispiele aufgeführt, welche einen Beitrag zum 3R-Prinzip leisten:
DFG Forschungsgruppe FOR 2591"Severity Assessment in Animal-based Research"
Im Rahmen des DFG-geförderten Forschungsprojektes „Verfeinerung der präklinischen onkologischen Forschung“ erfolgt eine datenbasierte Belastungsanalyse mit verschiedenen physiologischen, biochemischen und Verhaltensparametern an unterschiedlichen murinen Modellen zum kolorektalen und Pankreas-Karzinom. Zeitgleich werden innovative Kombinationstherapien in vivo getestet. Diese datenbasierte Belastungseinschätzung ermöglicht die Etablierung von verschiedenen Refinement-Methoden wie frühe humane Endpunkte, frühzeitige Erkennung von Nebenwirkungen spezieller Therapeutika und die Optimierung des Analgesie-Regimes, um die Belastung der Versuchstiere in präklinischen, onkologischen Studien nachhaltig zu reduzieren.
ALL-Refine: Evidenzbasierte Belastungseinschätzung und verschiedene Refinement-Strategien im murinen orthotopen Xenograft-Modell der akuten lymphatischen Leukämie (Dr. S. Kumstel, IEC / Dr. A. Richter, HämatoOnko)
Im Rahmen der BMBF Förderung von „Alternativmethoden zum Tierversuch“ erfolgt im Projekt ALL-Refine eine detaillierte, datenbasierte Belastungseinschätzung im murinen Xenograft-Modell zur akuten lymphatischen Leukämie und gleichzeitig wird eine innovative Kombinationstherapie getestet. Die multifaktorielle Belastungseinschätzung ermöglicht die Etablierung früher humaner Endpunkte und die Analyse der Wirkung verschiedener Analgetika. Durch longitudinale Bildgebung mittels Biolumineszenz und der durchflusszytometrischen Analyse des Blutes kann das Engraftment der leukämischen Blasten direkt mit der Belastung der Tiere korreliert werden und die Wirkung der Refinement-Methoden evaluiert werden. Ziel ist eine nachhaltige Reduktion der Belastung der Versuchstiere in diesem Tiermodell. Dieses Forschungsprojekt wird in Kooperation der Klinik für Hämatologie, Onkologie und Palliativmedizin durchgeführt.
Nutzung des CAM Assays
Im Rahmen des 3R Prinzips werden Tierversuche zunehmend reduziert und ersetzt. Allerdings simulieren selbst teure und komplexe in vitro Systeme nur einfache physiologische Interaktionen. Der Chorion Allantois Membran Assay kann als fortschrittliches Modell die Lücke zwischen in vivo- und in vitro-Forschung schließen. Die extraembryonale Membran sind mit dem Embryo durch ein kontinuierliches Kreislaufsystem verbunden, das für Manipulationen oder die longitudinale Überwachung von Tumorwachstum, Metastasierung, Angiogenese und Matrixumbau leicht zugänglich ist. Die Chorion Allantois Membran kann in ovo und ex ovopräpariert werden. Die klassische in ovo Präparation ermöglicht geringe Ausfallraten durch den Schutz der Chorion Allantois Membran in der gefensterten Schale. Die Exposition der Chorion Allantois Membran kann durch die ex ovo Präparation in einer Petrischale verbessert werden. Allerdings führt die artifizielle Umgebung zu höheren Ausfallraten (>50%). In beiden Präparationen werden Versuche nicht am Hühnerembryo selbst, sondern an der extraembryonalen Chorion Allantois Membran durchgeführt. Da die Membran nicht sensibel innerviert ist, bleibt die Belastung für den Hühnerembryo sehr gering. Der Chorion Allantois Membran Assay ermöglicht so die Untersuchung von pharmakologischen oder physikalischen Therapien mit hoher Reproduzierbarkeit in Einklang mit dem 3R Prinzip. Für weitere Informationen, bitte Dr. Daniel Strüder (HNO) kontaktieren.
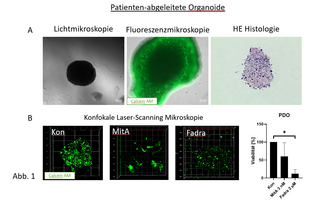
Präklinische Modelle für hochmaligne Tumoren – Patienten-abgeleitete Organoide und 3D-Bioprints ((PD Dr. rer. nat. C. Maletzki, M. Sc. T. Freitag, P. Kaps, Häma/Onko)
Die Etablierung Patienten-individueller Tumormodelle erfolgt entweder in Zellkultur-basierten Ansätzen oder im Rahmen komplexer tierexperimenteller Studien. Die meisten Modelle reflektieren jedoch nicht die Tumorheterogenität und erfassen nicht alle Aspekte, die zur Komplexität beitragen. Um gleichzeitig physiologische und speziesrelevante Ergebnisse unter Berücksichtigung des 3R-Prinzips zu generieren, wurden komplexe zellbasierte Techniken etabliert. Dazu gehören Patienten-abgeleitete Organoide (PDO) und 3D-Bioprints. Im Rahmen unseres Forschungsprojektes werden PDOs aus Resektaten von Glioblastomen durch Kultivierung in definiertem Zellkulturmedium etabliert und zell- sowie molekularbiologisch charakterisiert (Abb. 1A). Zusätzlich erfolgt die Testung neuartiger Therapien in diesen Modellen (Abb. 1B). Das Ansprechen wird mit Daten aus 2D- und 3D-Modellen verglichen. In einem parallelen Ansatz erfolgt die Etablierung biomimetischer 3D-Bioprints (Abb. 2). Die Bioprints sollen ausgehend von einfachen Monokulturen sukzessive optimiert werden, um schließlich multizelluläre Strukturen in vitro kultivieren und damit die native Tumorarchitektur und die Komplexität der Mikroumgebung möglichst realitätsnah abbilden zu können.
Wir streben den Aufbau einer Technologieplattform an, die die standardisierte Kultivierung Patienten-abgeleiteter Tumormodelle zur Durchführung präklinischer Therapiestudien im Sinne des 3R-Prinzips ermöglicht.
Kooperationspartner:
Klinik für Neurochirurgie, PD Dr. med. habil. Daniel Dubinski M.Sc.
Universität Rostock, Lehrstuhl für Mikrofluidik, Prof. Dr.-Ing. H. Seitz und M. Sc. Christian Polley